حلول أسئلة الصف الثاني المتوسط
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى
مراجعة الفصل الأول
س1- أكمل العبارات الآتية بما يناسبها:
- العنصر الذي يمتلك إلكترونين فقط في غلافه الخارجي المشبع هو ثنائي التكافؤ.
- ذرات العنصر التي تميل إلى فقدان إلكترونات تكون روابط أيونية.
- عند اتحاد ثلاث عناصر X ،Y ،Z لتكوين مركب ما فإن خواص المركب الجديد XYZ تختلف عن خواص العناصر المكونة لها.
- تتكون الرابطة الأيونية عندما تنتقل إلكترونات من ذرة إلى أخرى.
- في الرابطة الأيونية يكون التجاذب بين أيونات ذوات شحنات مختلفة.
- إلكترونات التكافؤ هي المسؤولة عن تكوين الروابط.
س2- اختر الإجابة الصحيحة في كل مما يأتي:
1- ماذا يحدث عندما تصبح الذرة أيوناً ذا شحنة 2-؟
- اكتساب الذرة بروتونين.
- فقدان الذرة إلكترونين.
- اكتساب الذرة إلكترونين.
- فقدان الذرة بروتونين.
2- يتكون المركب من:
- أنواع مختلفة من الذرات مختلطة معاً.
- نفس النوع من الذرات مختلطة معاً.
- أنواع مختلفة من الذرات متحدة معاً كيميائياً.
- نفس النوع من الذرات متحدة كيميائياً.
3- عندما تتحول ذرة الكالسيوم إلى أيون كالسيوم 2+Ca فإنها:
- تفقد إلكتروناً.
- تفقد إلكترونين.
- تكتسب إلكترونين.
- يزداد عدد البروتونات.
4- أي عنصرين مما يلي يمكنهما أن يكونا مركباً تساهمياً؟
- الصوديوم والأوكسجين.
- النحاس والأوكسجين.
- الكاربون والأوكسجين.
- المغنيزيوم والأوكسجين.
5- أي من أنواع الذرات التالية تتكون أيونات سالبة؟
- الفلزات.
- العناصر النبيلة.
- اللافلزات.
- جميع ما ورد.
6- ما نوع الرابطة التي تربط الذرات معا في جزيء كلوريد الهيدروجين HCl؟
- رابطة ايونية ويحدث فيها تشارك الالكترونات.
- رابطة تساهمية ويحدث فيها فقد الكترونات واكتسابها.
- رابطة تساهمية ويحدث فيها تشارك الكترونات.
- رابطة ايونية
7- اي مما يلي سيرتبط عىل االرجح برابطة ايونية؟
- ايون فلز موجب الشحنة وايون لا فلز موجب الشحنة.
- ايون فلز موجب الشحنة وايون لا فلز سالب الشحنة.
- ايون فلز سالب الشحنة وايون لا فلز موجب الشحنة.
- ايون فلز سالب الشحنة وايون لا فلز سالب الشحنة.
س3- أجب عما يلي بإجابات قصيرة:
1- ما عدد الإلكترونات المفقودة أو المكتسبة لذرات العناصر أدناه ليكون لها 8 إلكترونات تكافؤ؟
عدد الإلكترونات المكتسبة -2e: إلكترونين.
2 - ماهي شحنة الأيون المتكون.
- كبريت S: كبريت 2-S.
- ألمنيوم Al: ألمنيوم 3+Al.
- كالسيوم Ca: كالسيوم 2+Ca.
- فسفور P: فسفور 3+P.
3- بين سبب استقرار العناصر النبيلة.
لأن أغلفتها الخارجية مشبعة وطاقتها واطئة لذا تكون أكثر استقراراً.
4- ماذا تعني العبارة الآتية (العدد الكتلي = العدد الذري) بالنسبة لذرة الهيدروجين 11H؟
- إن العدد الذري يمثل عدد الإلكترونات في الغلاف الخارجي.
- أن النواة تحوي على كثافة كتلية عالية في مركز الذرة ولها شحنة موجبة تعادل أو تساوي عدد الإلكترونات الخارجية السالبة الشحنة لذا يحصل توازن بين الشحنات الموجبة والسالبة.
5- قارن بين أنواع الترابط الكيميائي من حيث ما يحدث لإلكترونات تكافؤ الذرات وخواصها.
| الرابطة الأيونية | الرابطة التساهمية |
|
|
6- استعن بالشكل الذي يبين الترتيب الإلكتروني للإجابة عما يلي:
أ- كم إلكتروناً يوجد في الغلاف الخارجي لذرة الليثيوم؟ ولذرة الكلور؟
- ذرة الليثيوم: يوجد إلكترون واحد خارجي.
- ذرة الكلور: يوجد 7 إلكترونات خارجية.
ب- أي من ذرات العناصر تكون أيوناً موجباً وأي منها تكون أيوناً سالباً؟ ولماذا؟
- ذرة الليثيوم Li: تكون أيون موجب لأنها تفقد الإلكترون وتتحول إلى أيون موجب.
- ذرة الكلور Cl: يكتسب إلكترون واحد ويتحول إلى أيون سالب.
ج- ما مقدار العدد الذري لذرة الليثيوم؟ ولذرة الكلور؟
- العدد الذري لليثيوم: Li=3.
- العدد الذري للكلور: Cl=17.
د- كم إلكتروناً تفقد ذرة الليثيوم وكم إلكتروناً تكتسب ذرة الكلور؟ ولماذا؟
- ذرة الليثيوم: تفقد إلكتروناً واحداً.
- ذرة الكلور: تكتسب إلكتروناً واحداً.
هـ- ما نوع الرابطة المتكونة بينهما؟
رابطة أيونية.
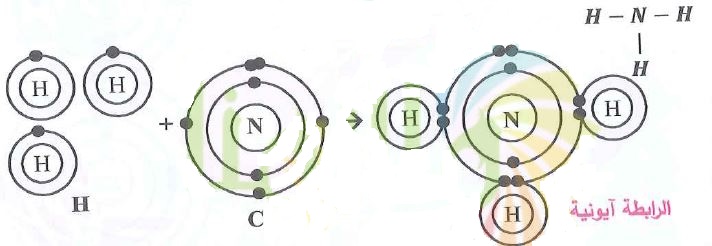
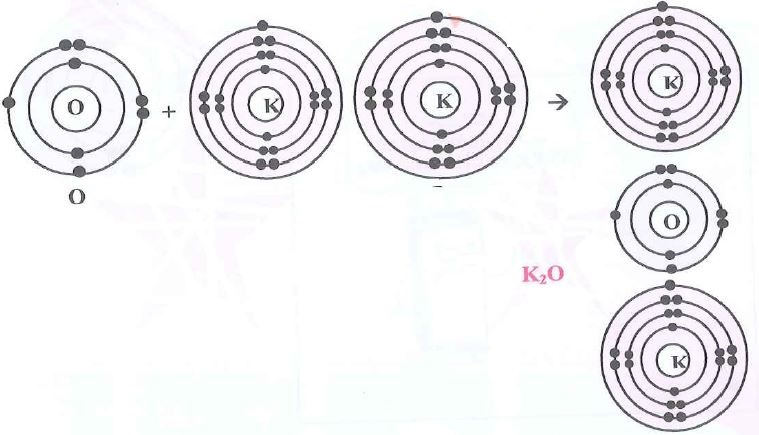
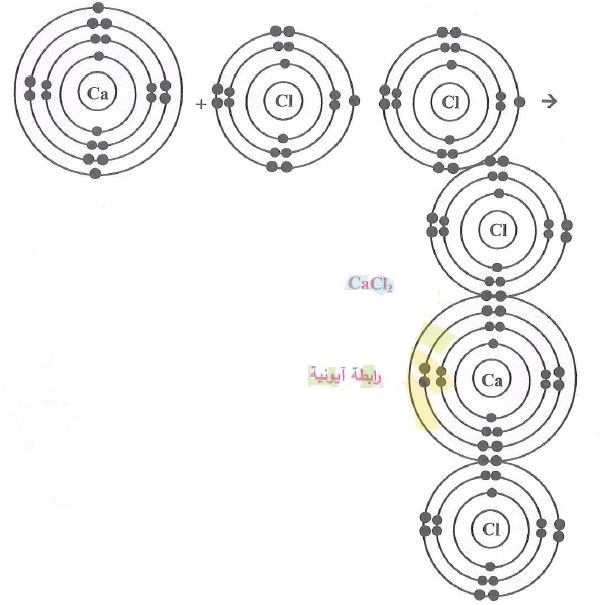
س4- ارسم مخططاً يوضع الترتيب الإلكتروني لذرة وأيون كل عنصر والروابط المتكونة في المركبات الآتية:
1- فلوريد الهيدروجين HF.
2- الميثان CH4.
3- الأمونيا NH3.
4- أوكسيد البوتاسيوم K2O.
5- كلوريد الكالسيوم CaCl2.
س5- أعط أسماء الأيونات الموجبة والسالبة فيما يأتي:
-
Al+3: أيون الألمنيوم.
-
+H: بروتون أيون الهيدروجين.
-
3+Fe: أيون الحديد III.
-
2+Fe: أيون الحديد II.
-
NH+4: أيون الأمونيوم.
-
CO3-2: أيون الكاربونات.
-
-I: أيون الأيونيد.
-
-ClO3: أيون الكلورات.
-
2-SO4: أيون الكبريتات.
-
-NO3: أيون ثلاثي أوكسيد النتروجين (أيون النترات).
حلول أسئلة الصف الثاني المتوسط
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى

.JPG)
.JPG)
.JPG)
.JPG)


النقاشات