حلول أسئلة الصف الأول المتوسط
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى
الدرس الأول: مكونات المادة
ما إسم الجسيمات الموجودة داخل النواة؟
الجسيمات التي موجودة داخل النواة هي:
- البروتون (+P): ويحمل شحنة موجبة.
- النيوترون (+n): جسيم متعادل الشحنة.
ذرة عنصر الأوكسجين O تحتوي على 8 بروتونات 8 نيترونات اكتب العدد الذري والعدد الكتلي.
العدد الذري (Z)=عدد البروتونات +P
Z= 8
العدد الكتلي=عدد البروتونات (+P) +عدد النيوترونات (N)
8 + 8 = 16
ما هو رمز العنصر؟ وما أهميته؟
هو طريقة لتمثيل العناصر في الطبيعة.
كيف تمثل العدد الذري والكتلي لعنصر الصوديوم عدده الذري 11 وعدد كتلته 23.
ما المدار الإلكتروني؟
المدارات الإلكترونية: وهي المناطق التي تدور فيها الإلكترونات حول النواة بسرعة فائقة ويكون لكل مدار عدد محدد من الإلكترونات التي يمكنها الدوران فيه وعددها (7) مدارات.
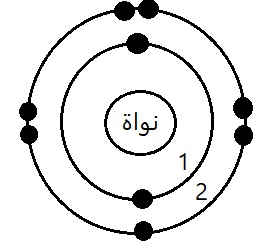
ارسم التوزيع الإلكتروني لعنصر الهيليوم He عدد الذري 2.
- عنصر الهيليوم He عدد الذري (2=Z).
- عدد الإلكترونات=2.

رتب المدارات الثلاثة الأولى للذرة في جدول واذكر عدد الالكترونات في كل مدار رقم المدار.
| رقم المدار | عدد الإلكترونات |
| المدار الأول | 2 إلكترون |
| المدار الثاني | 8 إلكترون |
| المدار الثالث | 8 إلكترون |
الفكرة الرئيسة:
1) ما مكونات الذرة؟
تتكون الذرة من: النواة والإلكترونات.
2) ماذا تحوي نواة الذرة؟
تحوي على البروتونات (+P) والنيوترونات (N0).
المفردات:
3) ماذا يعني لك مفهوم العدد الكتلي؟
هو مجموع عدد البروتونات والنيوترونات الموجودة داخل النواة.
4) قارن بين العدد الذري والعدد الكتلي.
- العدد الذري (Z)= عدد البروتونات +P=عدد الإلكترونات.
- العدد الكتلي (A)= عدد البروتونات + عدد النيوترونات.
5) وضح ما المقصود بالمدارات الإلكترونية والتوزيع الإلكتروني.
- المدارات الإلكترونية: وهي المناطق التي تدور فيها الإلكترونات حول النواة بسرعة فائقة ويكون لكل مدار عدد محدد من الإلكترونات التي يمكنها الدوران فيه وعددها (7) مدارات.
- التوزيع الإلكتروني: وهي عملية توزيع الإلكترونات في الذرة على المدارات الإلكترونية حيث يكون لكل مدار عدد محدد من الإلكترونات فالمدار الأول يستوعب (إلكترونين) والثاني (8 إلكترونات) والثالث (8 إلكترونات).
6) قارن بين النواة والذرة من حيث الحجم.
مركز الذرة الذي تشغله النواة صغير جداً إذ تمثل أصغر من (100000) مرة من حجم الذرة.
7) قارن بين النواة والإلكترونات من حيث الكتلة.
إن كتلة الإلكترون أصغر بحوالي (1840) من كتلة النواة التي يشغلها (البروتون والنيوترون).
1) ما العدد الذري والعدد الكتلي لعنصر الالمنيوم احسب العدد الذري والعدد الكتلي؟
عنصر الالمنيوم AI:
- العدد الذري=13.
- العدد الكتلي=27.
2) ارسم ذرة عنصر الفلور F التي تحوي تسع إلكترونات موضحاً فيها التوزيع الإلكتروني على المدارات، ثم أكمل الجدول التالي:
الفلور F:
عدد الإلكترونات=9=عدد البروتونات.
| المدار | رقمه | عدد الإلكترونات | عدد البروتونات |
| الأول | 1 | 2 | 2 |
| الثاني | 2 | 7 | 7 |
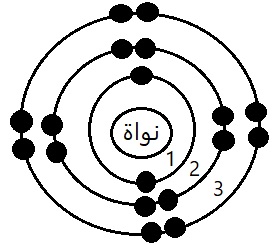
3) لديك ذرة عنصر تحوي على ثلاث مدارات ممتلئة بالإلكترونات، ارسم مدارات هذه الذرة، ثم احسب العدد الذري.
- المدار الأول 2 إلكترون.
- المدار الثاني 8 إلكترونات.
- المدار الثالث 8 إلكترونات.
- العدد الذري (Z)=عدد الإلكترونات=عدد البروتونات.
- العدد الذري (Z)=2+8+8=18=عدد البروتونات.
حلول أسئلة الصف الأول المتوسط
حل اسئلة رياضيات - علوم - عربي وجميع الكتب والمواد الأخرى

.JPG)





النقاشات